Az UCSF (University of California, San Francisco) Gladstone intézetében komoly áttörést értek el az SM okának kutatásában. A kutatásról részletesen a Nature 2012 novemberi 27-i számában lehet olvasni, a következőkben megpróbálom összefoglalni az eredményt.
- Megmutattuk, hogy a fibrinogén az oka mindennek - mondta Katerina Akassoglou, Ph.D. (kutató - Gladstone Institute for Neurological Disease, a neurológia professzora - University of California, San Francisco,)
A fibrinogén a fibrin proteinje mely a véralvadásban játszik szerepet. Amikor pl. a lábon kialakul egy visszér, akkor a fibrinogén kilép a vénán keresztül és fibrin hálóvá alakulva lerakódik körülötte. Ez a fibrin mandzsetta, mely SMben is megtalálható.
Dr. Akassoglou és kollegái egereket vizsgáltak, melyekben EAE-t idéztek elő, mely az emberi SM betegségnek egy nagyon régi kísérleti modellje. A kutatók a legújabb mikroszkópos technológiát használták (two-photon laser scanning microscopy) melynek segítségével élő egereket tudtak sejt szinten megfigyelni. A technológia alkalmas a sejtek mozgásának filmszerű rögzítésére, gyakorlatilag sejtről sejtre követhető, mi történt.
A kutatók megmutatták, hogy a fibrinogén szivárgása az érből és az ehhez kapcsolódó mikroglia aktiválás napokkal az idegsejtek roncsolódása ELŐTT megtörtént, ami azt sugallja hogy ez az SM betegség nagyon korai szakaszában történik.
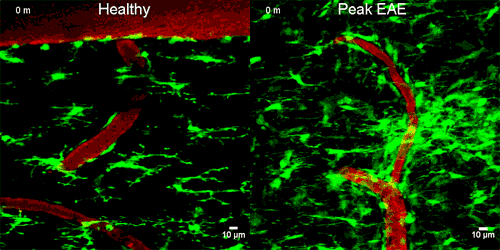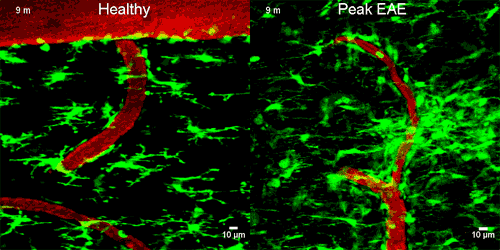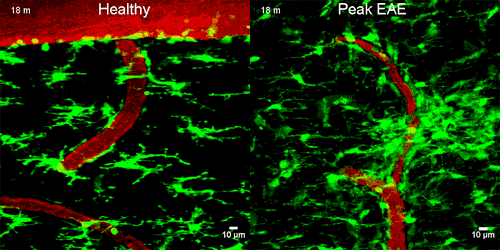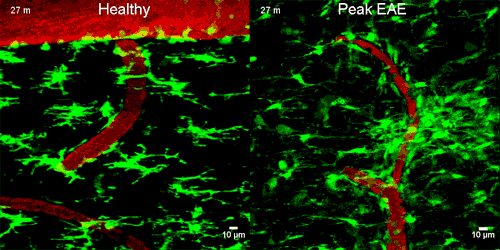
A képen zölddel a mikroglia sejtek látszanak, amint napokkal az idegsejtek roncsolódása ELŐTT elkezdenek gyülekezni a szivárgó ér körül
A mikroglia sejtek a normál agyban és gerincvelőben inaktívak, de a központi idegrendszer gyulladásos megbetegedéseiben immunológiai végrehajtó sejtekké alakulnak. Nyúlványaikat visszahúzzák és a károsodás helyére vándorolnak.
A mikroglia megváltoztatta az alakját és a CD11b/CD18 receptorhoz kötődött, majd reaktiv oxigén molekulákat engedett ki, melyek roncsolták az idegsejteket. Amikor a kutatók megakadályozták ezt a receptorhoz kötődést, akkor az idegsejt roncsolás sem történt meg. Ez azt jelenti, hogy az idegsejtek roncsolódásához a fibrinogén jelenléte SZÜKSÉGES.
"Fibrinogen-induced perivascular microglial clustering is REQUIRED for the development of axonal damage in neuroinflammation."
Eddig a legújabb kutatás ismertetése, források: NIH, UCSF
Ez az eredmény sokadszorra dönti meg azt amit eddig az SM -ről tudtunk. Eddig ugyanis azt gondolták, hogy az immunrendszer valamilyen okból megtámadja az idegsejtet borító mielin védőhüvelyt és ez okozza az idegsejt vezetőképességének romlását és a gyulladást, majd később az idegsejt pusztulását is. A fenti új eredmény szerint ez pont fordítva történik, ráadásul érrendszeri oka van, nem pedig autoimmun.
A fenti a kutatás szerint ELŐSZÖR van a fibrin kijutás az érből, ami halálos az idegsejtekre. A demielinizáció és a gyulladás csak UTÁNA van, melyet már az immunrendszer okoz, mely el akarja takarítani az útból a vérből kijutott fibrinogént. Azaz az immunrendszer csak a dolgát végzi. A jelenlegi SM gyógyszerek pedig pont erre a folyamatra hatnak, tehát NEM az idegsejt roncsolást állítják meg, hanem éppenséggel az épen működő immunrendszert. Azaz a jelenlegi SM gyógyszerek nem az SM okát kezelik.
Arról nem szól ez a kutatási anyag, hogy MIÉRT történik a fibrin kiválás, miért sérül az agy-vér gát. Sokminden lehet az oka, és mivel az emberben levő SM betegség jelentősen különbözik az egérmodelltől, fontos megvizsgálni, hogy mi lehet az agy-vér gát sérülésének oka emberben. Ugyanis a fentiek fényében ha bármilyen okból fibrinogén jut ki az érfalon át, akkor az halálos fenyegetés az idegsejtekre mely beindíthatja az SM betegséget.
Dr. Zamboni volt az első, aki azt találta 2006-ban, hogy az SM gócok úgy néznek ki mint a vénás fekélyek, mivel fibrin mandzsetta található a véna körül. Őszerinte a CCSVI vénaszűkületek miatt változik a véráramlás megszokott módja, ami miatt lassul a vér keringése és átjárhatóvá válik az agy-vér gát.
A hipoperfúzió azaz lassult agyi véráramlás már önmagában is azonnali fibrin kiválást okoz, ami a fentiek szerint halálos az idegsejtekre.
One of the most surprising findings of the present study is that the decline of cerebral blood flow (CBF) in conjunction with hypoxia is sufficient to induce rapid microvascular thrombosis and fibrin deposition within the brain. By analyzing challenged fibrinogen-null mice we have established that fibrin(ogen) plays an important role the reperfusion deficits and brain infarction (Figure 10). These results suggest that if cerebral ischemia is accompanied with hypoxia, this combination can precipitate local coagulation and impede reperfusion after ischemia, similar to the previously described no-reflow phenomenon after cerebral ischemia5 and cardiac arrest.56 It seems likely that fibrin stabilization of platelet thrombi is a major determinant of brain tissue damage. If so, we would predict that a similar, if not more impressive, protection from tissue damage could be realized in mice with a profound defect in platelet function. It is also conceivable that fibrin-mediated inflammatory processes drive secondary tissue damage in the brain. Thus, the modified Levine/Vannucci model described here may be useful for testing new therapies to restore postischemic reperfusion in the face of thrombolytic agents and other approaches to reopened large vessels.
Regarding the mechanism of ischemia/hypoxia-induced thrombosis, it seems likely that hypoxia alters the balance between anti- and procoagulation properties of the endothelial cells in cerebral blood vessels. Although focal ischemia can trigger platelet accumulation and fibrin deposition, these events typically show a late-onset after a transient hyperemia phase.49,53 In contrast, the present study shows that the combination of ischemia and hypoxia precipitates these events almost immediately.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1780162/
Márpedig az SM betegeknek lassult az agyi vérkeringése, ez széles körben elfogadtott tudományos tény. (link link link link link link)
Tovább gondolva a dolgot, a fibrinogén arra a folyamatra is magyarázatot adhat, mely progressziv SM betegeknél figyelhető meg és nincsen rá magyarázat: gyulladás nélkül is tovább folyik az idegsejtek roncsolódása.
Egyébként a fibrinogén gyulladáskeltő hatása sok betegségben ismert (érfal betegségek, gerincvelő sérülés, agyi truma, SM, Alzheimer, RA, baktérium fertőzés, rák, stb), azonban önmagában a fibrinogén okozta idegsejtpusztulás még nem minden.
A CCSVI nem csak az agy-vér gátat gyengíti meg, hanem emelett csökkenti a keringő vér és agyvíz mennyiséget, növeli az agyvíz nyomást az agytörzsben, csökkenti az oxigén ellátottságot, csökkenti a tápanyag ellátottságot, valamint rontja az idegrendszer öntiszító funcióit. Mindezt évtizedeken keresztül. Talán ezek együtt okozzák azt a betegséget, amit mi SM-nek hívunk.
László
msccsvi@gmail.com


